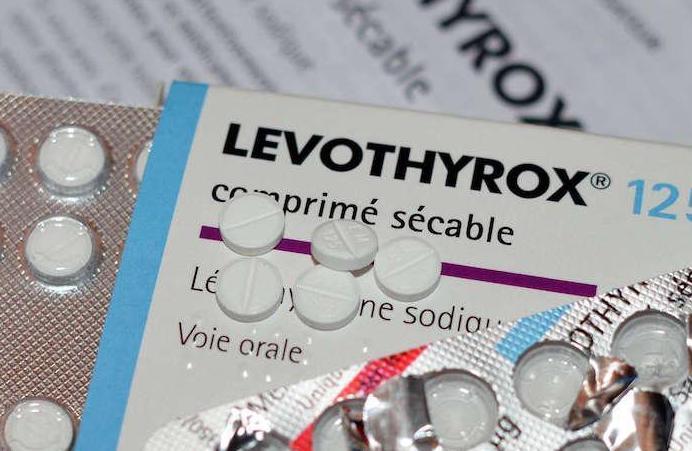
Depuis le changement, fin mars, de la formule du Levothyrox par le laboratoire Merck, des milliers de patients ont fait part d’effets indésirables pénibles ou insupportables, sur les 3 millions qui en prennent. Pour mémoire, ce changement de formule ne concerne que les « excipients », les produits inertes du comprimé, et visait à répondre à une demande de l’Agence du Médicament qui voulait assurer la stabilité du médicament.
Des signalements de malades dès juillet
Dès le mois de juillet, les réseaux sociaux et les associations de malades avaient révélé les premiers signalements d’effets indésirables. Ce n’est qu’à la mi-août que la presse s’est faite l’écho d’une pétition de malades sous Levothyrox dénonçant les effets indésirables occasionnés par la nouvelle formule et qui comptait déjà 20 000 premiers signataires. Dans les jours suivants, la pétition demandant le retour à l’ancienne formule est signée par 312 000 personnes et les notifications d’effets indésirables se multiplient sur le portail de pharmacovigilance de l’ANSM pour atteindre plus de 20 000.
Auto-déstabilisation de l’ANSM
Un comble : l’agence est déstabilisée par l’amélioration de son propre système de pharmacovigilance qui ne concerne désormais plus seulement les médecins mais aussi les patients. Même si cela ne fait que moins de 1% des malades, la crise est lancée et ne s’arrêtera plus.
Pourtant, l’Agence pensait avoir bien fait puisqu’elle avait envoyé une lettre d’information à 400 000 professionnels de santé avant mars pour annoncer ce changement. Une information qui n’a servi à rien puisqu’elle ne soulevait pas l’hypothèse d’effets indésirables aussi forts... puisque ce n'était pas anticipé !
Un manque d’anticipation
Pourtant, il y avait matière à penser qu’il se passerait quelque chose puisque en 2009, en France, un générique du Levothyrox avait déjà été proposé. Les réactions de certains malades avaient déjà été si fortes que l’Agence du médicament avait recommandé aux médecins de surveiller les « malades à risque » et que les médecins avaient rapidement arrêté de prescrire le générique. Ils avaient même mis « non substituable » sur leurs ordonnances de Levothyrox, afin que les pharmaciens ne puissent le remplacer par le générique.
L’Agence pouvait également se tourner vers l’étranger où ce changement vers la nouvelle formule a déjà été réalisé (Danemark, Nouvelle-Zélande…), afin de voir comment cela s’était passé.
L’agence est au pied du mur
Aujourd’hui, après avoir demandé au laboratoire Merck d’importer en 2 occasions 200 000 boites de l’ancienne formule, il n’y en aura plus car les lignes de productions ont été arrêtées et il faut au moins 4 mois si l’on veut les relancer et même si 4 autres médicaments existent désormais, ils ne sont pas strictement identiques à l’ancienne formule.
L’Agence est au pied du mur et c’est pour essayer de reprendre la main qu’elle a lancé dans une conférence de presse le 8 décembre toute une série de pistes pour améliorer la gestion de ce type de crise : en 2 mots, il s’agit d’élargir les « analyses de risques » en surveillant mieux les réseaux sociaux, et de développer de nouveaux outils d’information et de gestion des risques.
Information, surveillance et gestion des données
L’information des médecins par des courriers ne peut pas être l’alpha et l’oméga de l’information de l’ANSM qui réfléchit sur le développement d’une application qui serait dirigée autant vers les médecins que vers les patients. Quant à la surveillance des réseaux sociaux, de nombreuses études scientifiques font état de la surveillance des tweets, par exemple pour déceler le début d’une épidémie de grippe. Ce n’est pas plus efficace qu’une bonne pharmacovigilance, mais cela donne rapidement d’autres renseignements. Le portail de pharmacovigilance de l’ANSM a pourtant joué son rôle en se domaine : dès que les patients ont appris par la presse qu’ils leur était possible de déclarer leurs effets indésirable, le nombre de signalement a bondi : il a été multiplié par 80 en quelques jours et la part des signalements par les patients est passée de 5% en temps normal à plus de 90%. Cependant, ces données n’ont pas été exploitées assez vite.
Respecter la parole des patients
En fait, on a beau vouloir développer tous les systèmes du monde, cela ne sert à rien si les médecins et l’Agence du médicament ne prennent pas réellement en compte les plaintes des malades. Comme le changement de formule ne peut pas, sur le plan pharmacologique, être responsable d’une quelconque toxicité, tout le monde met ces signalement d’effets indésirables, au mieux sur une autre maladie associée, au pire sur une « hypersensibilité » des malades. L’ANSM rappelle ainsi que près de 15% des malades se plaignaient déjà d’effets indésirables à un moment de l’année quand ils étaient sous traitement avec l’ancienne formule du Levothyrox.
L’ANSM et les médecins n’ont pas voulu envisager que les malades puissent souffrir et c’est là que le bât blesse. C’est aussi pour cela que les procès s’annoncent avec différentes possibilités d’attaque et de juridictions : défaut d’information, tromperie ou incompétence de l’agence. C’est plusieurs occasions de gagner.