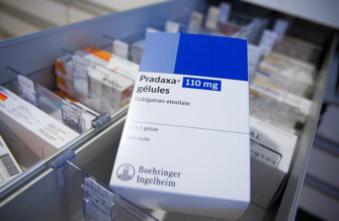
Prévenir les risques cardiovasculaires n’est pas une mince affaire. Prise de pouls, bilans sanguins réguliers... Le médicament Pradaxa, fabriqué et commercialisé par le laboratoire Boehringer « éviterait ces précautions quotidiennes », selon son fabricant. Cependant, la revue médicale britannique The Bristish Medical Journal (BMJ) a publié ce mercredi une enquête polémique. Elle révèle que le laboratoire a dissimulé des informations de sécurité importantes relatives au médicament. « Des affirmations trompeuses », selon le laboratoire allemand, qui a répondu à ces accusations le soir même dans un communiqué.
Moins de risques d’hémorragies
Le Pradaxa est un anticoagulant oral en vente sur le marché pharmaceutique depuis 2008. Il peut, comme les autres anticoagulants, être à l’origine de complications hémorragiques parfois graves. Mais selon l’argument de vente du laboratoire Boehringer, les tests sanguins pour prévenir des AVC ne seraient plus nécessaires grâce à la prise de ce médicament. L'enquête du BMJ, elle, estime que l’industrie pharmaceutique allemande a négligé des données de sécurité. Le journal accuse le laboratoire d'avoir dissimulé des documents montrant qu’un contrôle sanguin permettrait une réduction de 30 à 40 % des hémorragies provoquées par la prise de ce Naco (Nouvel anticoagulant oral). « Le BMJ a découvert que les médecins et les autorités réglementaires n'avaient jamais entendu parler de ces calculs », assure la revue dans un communiqué.
Les agences sanitaires alertées
Face à ces accusations, le laboratoire allemand a riposté en publiant un communiqué mercredi soir, dans lequel il qualifie les propos de la revue britannique d'« affirmations trompeuses ». Il se défend en soutenant que « les caractéristiques des patients, tels que l'âge, l'état de la fonction rénale et la prise de certains médicaments, sont des facteurs essentiels contribuant au risque de saignement ». Les agences sanitaires américaine (FDA) et européenne (EMA), qui ont respectivement donné leur feu vert pour la commercialisation du médicament en 2010 et 2011, assurent avoir été vigilantes. Leur approbation de la mise en vente du médicament reposant exclusivement sur les informations fournies par le laboratoire, elles indiquent avoir suivi les rapports avec attention. « Nous prendrons les mesures nécessaires si de nouvelles informations nous parviennent », a précisé l’EMA.
Fin 2011, des plaintes pour cas de graves hémorragies ont commencé à émerger en Europe, note le BMJ. En France, 4 personnes sont décédées d’hémorragies suite à la prise de Pradaxa au début de l’année 2013. Leurs familles ont décidé de porter plainte pour homicide involontaire. Un scandale que la Haute Autorité de santé avait tenté de tempérer, en rappelant que « les Naco représentent seulement une alternative au traitement de référence ». Pour répondre à la potentielle nouvelle polémique lancée par la revue anglaise, le laboratoire Boehringer quant à lui recommande aux patients de « ne pas arrêter leur traitement sans en parler préalablement à leur médecin ».