Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament appartient au(x) groupe(s) générique(s) suivants :
 Solution (Composition pour 1 ml)
Solution (Composition pour 1 ml)
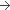 500 mg
500 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 21/07/2021 | Extension d'indication | La Commission considère que le service médical rendu par XYREM (oxybate de sodium) est important uniquement dans le traitement de la narcolepsie avec cataplexie chez les adolescents et les enfants à partir de 7 ans pharmacorésistants. |
| Insuffisant | Avis du 21/07/2021 | Extension d'indication | La Commission considère que le service médical rendu par XYREM (oxybate de sodium) est insuffisant pour justifier dune prise en charge par la solidarité nationale dans les autres situations de lextension dindication AMM correspondant aux enfants de 7 ans et plus et adolescents non pharmacorésistants. |
| Commentaires | Avis du 25/01/2017 | Inscription (CT) | La mise à disposition en ville de XYREM nest pas de nature à modifier les précédentes conclusions de la Commission en date du 10 mai 2006 et du 24 octobre 2007. |
| Important | Avis du 24/10/2007 | Modification des conditions d'inscription (CT) | Le service médical rendu par cette spécialité est important dans le traitement de la narcolepsie chez les patients adultes présentant une cataplexie. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Avis du 21/07/2021 | Extension d'indication | " Compte tenu : - de la démonstration de la supériorité de loxybate de sodium par rapport au placebo évaluée au cours dune étude de retrait de traitement randomisée en double aveugle sur 2 semaines chez des enfants de 7 ans et plus et des adolescents atteints de narcolepsie avec cataplexie : o sur le critère de jugement principal de variation du nombre médian de crises de cataplexie hebdomadaires avec une différence cliniquement pertinente (0 crise dans le groupe oxybate de sodium versus 12,7 dans le groupe placebo . p=0,0002), et . o sur les deux critères de jugement secondaires hiérarchisés cliniques de score CGIc dimpression globale de changement de la sévérité des cataplexies et déchelle de somnolence diurne ESS (CHAD) - de labsence de données versus comparateur actif dans un contexte où la moitié des patients (50 %) avaient reçu des traitements antérieurs par stimulants (principalement du méthylphénidate et du modafinil) puis de façon concomitante tout au long de létude, - du profil |
|
| Avis du 24/10/2007 | Modification des conditions d'inscription (CT) | Les nouvelles données présentées ne sont pas de nature à modifier l'amélioration du service médical rendu (ASMR IV) attribuée à XYREM dans le précédent avis (avis de la Commission de la transparence du 10 mai 2006). |