Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament n'appartient à aucun groupe générique
 Gélule (Composition pour Une gélule)
Gélule (Composition pour Une gélule)
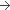 50 mg
50 mg
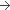 59,25 mg
59,25 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Faible | Avis du 05/10/2022 | Réévaluation SMR et ASMR | Le service médical rendu par TAFINLAR (dabrafenib) / MEKINIST (trametinib) reste faible uniquement dans le traitement des patients adultes atteints dun cancer bronchique non à petites cellules (CBNPC) avancé ayant une mutation BRAF V600E, en 2ème ligne de traite-ment ou plus, après échec des traitements standards actuels (chimiothérapie et/ou immuno-thérapie). |
| Faible | Avis du 08/01/2020 | Réévaluation SMR | Le service médical rendu (SMR) par lassociation TAFINLAR / MEKINIST est faible dans le traitement des patients adultes ayant un CBNPC avancé uniquement chez les patients porteurs dune mutation BRAF V600E et en 2ème ligne de traitement et plus, après échec de la chimiothérapie et/ou immunothérapie. La Commission conditionne le maintien du SMR à la mise en place dun recueil de données observationnelles des patients traités par lassociation TAFINLAR / MEKINIST pour un CBNPC avancé porteur dune mutation BRAF V600 en vue dune réévaluation de lassociation TAFINLAR / MEKINIST dans un délai de 2 ans (cf. 010. Autres recommandations de la Commission). |
| Insuffisant | Avis du 08/01/2020 | Réévaluation SMR | Le service médical rendu (SMR) par lassociation TAFINLAR / MEKINIST est insuffisant pour justifier dune prise en charge par la solidarité nationale dans les autres situations en 2ème ligne de traitement et plus. Pour rappel, la Commission dans son avis du 7 mars 2018 a considéré que le SMR chez les patients adultes ayant un CBNPC avancé, porteur dune mutation BRAF V600 en 1ère ligne de traitement était insuffisant pour justifier dune prise en charge par la solidarité nationale. |
| Important | Avis du 17/04/2019 | Renouvellement d'inscription (CT) | Le service médical rendu par TAFINLAR reste important : - en monothérapie dans le mélanome, - dans le mélanome, en association au MEKINIST - en adjuvant dans le mélanome, en association au MEKINIST |
| Insuffisant | Avis du 17/04/2019 | Renouvellement d'inscription (CT) | Le service médical rendu par TAFINLAR reste insuffisant dans le cancer bronchique non à petite cellules. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 05/10/2022 | Réévaluation SMR et ASMR | " Prenant en compte les nouvelles données versées au dossier fondées sur : ¿ des données de suivi de létude pivot non comparative, ¿ des données détudes rétrospectives, la Commission considère que lamélioration du service médical rendu (ASMR) attribuée à lassociation TAFINLAR (dabrafenib) / MEKINIST (trametinib) dans son avis du 8 juin 2020 reste inchangée à savoir une absence damélioration du service médical rendu (ASMR V) dans la prise en charge des patients ayant un CBNPC porteur de la mutation BRAF V600E, en 2ème ligne de traitement et plus, après échec dune chimiothérapie et/ou dune immunothérapie. " |
| V (Inexistant) | Avis du 08/01/2020 | Réévaluation SMR | " Compte tenu : - des résultats cliniques issus dune étude de cohorte de phase II non comparative ouverte ayant montré un taux de réponse globale de 63 % chez des patients ayant un CBNPC porteur de la mutation BRAF V600E, en 2ème ligne de traitement et plus chez des patients ayant reçu une chimiothérapie . - de labsence de données chez les patients traités antérieurement par immunothérapie . - de labsence de comparaison directe versus les traitements standards actuels (chimiothérapie et immunothérapie), notamment versus chimiothérapie alors que celle-ci était faisable . la Commission considère que lassociation TAFINLAR / MEKINIST napporte pas damélioration du service médical rendu (ASMR V) dans la prise en charge des patients ayant un CBNPC porteur de la mutation BRAF V600E, en 2ème ligne de traitement et plus, après échec de la chimiothérapie et/ou immunothérapie. " |
| Avis du 06/02/2019 | Extension d'indication | " Prenant en compte : - la démonstration de la supériorité de lassociation TAFINLAR/MEKINIST par rapport à un placebo sur la réduction du risque de récidive (16,6 mois dans le groupe placebo et non atteinte dans le groupe TAFINLAR/MEKINIST) chez les patients atteints dun mélanome cutané de stade III, porteur dune mutation BRAF V600E/K, après résection complète, - de limmaturité des données de survie globale pour conclure sur un avantage de TAFINLAR/MEKINIST par rapport au placebo sur ce critère de jugement, - du profil de toxicité connu de cette association avec notamment lobservation de réduction de la fraction déjection ventriculaire gauche (FEVG) graves (3%), - le besoin médical important dans ce contexte compte tenu du risque de récidive élevé en cas datteinte ganglionnaire même après résection complète et de la faible efficacité du comparateur historique (interféron), comme OPDIVO, lassociation TAFINLAR/MEKINIST apporte une amélioration du service médical rendu modérée (ASMR III) |
|
| V (Inexistant) | Avis du 07/05/2014 | Inscription (CT) | TAFINLAR napporte pas damélioration du service médical rendu (ASMR V, inexistante) dans la prise en charge actuelle du mélanome non résécable ou métastatique porteur dune mutation BRAF V600. |