Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.

Ce médicament n'appartient à aucun groupe générique
 Gélule (Composition pour Une gélule)
Gélule (Composition pour Une gélule)
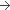 250 mg
250 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 24/05/2023 | Extension d'indication | Le service médical rendu par XALKORI (crizotinib), gélule, aux dosages de 250 mg et 200 mg, est important dans le traitement des patients pédiatriques (âgés de = 6 ans à < 18 ans) ayant un lymphome anaplasique à grandes cellules (LAGC) anaplastic lymphoma kinase (ALK)-positif systémique en rechute ou réfractaire. |
| Important | Avis du 19/04/2023 | Extension d'indication | Le service médical rendu par XALKORI (crizotinib), gélule, aux dosages de 250 mg et 200 mg, est important dans le traitement des patients pédiatriques (âgés de = 6 à < 18 ans) ayant une tumeur myofibroblastique inflammatoire (TMI) anaplastic lymphoma kinase (ALK)-positive non résécable en rechute ou réfractaire. |
| Faible | Avis du 13/05/2020 | Réévaluation SMR et ASMR | Le service médical rendu par XALKORI (crizotinib) est faible en deuxième ligne et plus, dans le traitement du cancer du poumon non à petites cellules (CPNPC) au stade avancé avec un réarrangement ROS1 (Proto-Oncogene 1, Receptor Tyrosine Kinase). |
| Insuffisant | Avis du 13/05/2020 | Réévaluation SMR et ASMR | Le service médical rendu par XALKORI (crizotinib) est insuffisant pour justifier d'une prise en charge par la solidarité nationale en première ligne de traitement, dans le traitement du cancer du poumon non à petites cellules (CPNPC) au stade avancé avec un réarrangement ROS1 (Proto-Oncogene 1, Receptor Tyrosine Kinase). |
| Important | Avis du 05/04/2017 | Extension d'indication | Le service médical rendu par XALKORI est important dans lextension dindication « en première ligne de traitement des patients adultes ayant un cancer du poumon non à petites cellules (CPNPC) anaplastic lymphoma kinase (ALK)-positif et avancé ». |
| Faible | Avis du 05/07/2017 | Extension d'indication | Le service médical rendu par XALKORI est faible en première ligne, dans le traitement du cancer du poumon non à petites cellules (CPNPC) au stade avancé avec un réarrangement ROS1 (Proto-Oncogene 1, Receptor Tyrosine Kinase). |
| Modéré | Avis du 05/07/2017 | Extension d'indication | Le service médical rendu par XALKORI est modéré en seconde ligne et plus, dans le traitement du cancer du poumon non à petites cellules (CPNPC) au stade avancé avec un réarrangement ROS1 (Proto-Oncogene 1, Receptor Tyrosine Kinase). |
| Important | Avis du 03/04/2013 | Inscription (CT) | Le service médical rendu par XALKORI est important dans le traitement de deuxième ligne du cancer bronchique non à petites cellules (CPNPC) anaplastic lymphoma kinase (ALK) positif au stade avancé. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Avis du 24/05/2023 | Extension d'indication | " Compte tenu : ¿ des données des études de phase I-II ADVL0912 et A8081013 suggérant une activité antitumorale du crizotinib dans le LAGC pédiatrique ALK-positif en rechute ou réfractaire avec des taux de réponse globale respectifs de 88,5 % (n=23/26) et de 56,3 % (n=9/16) et des taux de réponse complètes respectifs de 80,8 % (n=21/26) et de 50,0 % (n=8/16) . ¿ du besoin médical partiellement couvert dans le traitement de 2ème ligne et plus du LAGC ALK-positif chez lenfant . ¿ de lamélioration attendue mais non étayée des conditions de soins par rapport à la chimiothérapie avec une administration par voie orale du crizotinib (gélule) à domicile . et malgré : ¿ labsence de données comparatives dans la population pédiatrique visée dont les résultats ne permettent pas de tirer une conclusion robuste sur lapport thérapeutique du crizotinib par rapport aux alternatives disponibles . ¿ des données de tolérance limitées chez lenfant en termes de durée de recul avec un suivi médian de moins de |
|
| Avis du 19/04/2023 | Extension d'indication | XALKORI (crizotinib), gélule, aux dosages de 250 mg et 200 mg apporte une amélioration du service médical rendu mineure (ASMR IV) dans la stratégie thérapeutique des tumeurs myofibroblastiques inflammatoires (TMI) anaplastic lymphoma kinase (ALK) positives non résécables en rechute ou réfractaires chez les patients pédiatriques (âgés de = 6 à < 18 ans). | |
| V (Inexistant) | Avis du 13/05/2020 | Réévaluation SMR et ASMR | " Compte tenu : - des données cliniques limitées du crizotinib (XALKORI) avec un niveau de preuve faible (cohortes non comparatives issues détudes de phase I et II portant sur un critère intermédiaire), - de labsence de données comparatives robustes, directes ou indirectes, par rapport à la chimiothérapie habituellement utilisée chez les patients atteints de CPNPC avec réarrangement ROS1 alors quune comparaison avait été demandée par la Commission, - de labsence de donnée solide sur la valeur pronostique de la positivité du ROS1, la Commission considère que XALKORI (crizotinib) napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique. " |
| Avis du 05/04/2017 | Extension d'indication | " Compte tenu de : - la démonstration dun gain en survie sans progression - sans impact démontré sur la survie globale par rapport à une chimiothérapie à base de sels de platine, - la difficulté de transposer les résultats de létude pivot aux conditions réelles dutilisation (schémas de traitement différents entre les deux groupes de traitement, en faveur de XALKORI), la Commission considère que XALKORI apporte une ASMR mineure (ASMR IV) dans le traitement de première ligne du CPNPC ALK+ au stade avancé. " |
|
| V (Inexistant) | Avis du 05/07/2017 | Extension d'indication | " Compte tenu de : - données limitées (2 cohortes issues lune dune phase I et lautre dune phase II) avec un niveau de démonstration non optimal et portant sur un critère intermédiaire,- labsence de comparaison à la chimiothérapie habituellement utilisée dans ce contexte, - labsence de donnée solide sur la valeur pronostique de la positivité du ROS1, la Commission considère quen létat actuel du dossier, XALKORI napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique. " |
| Avis du 03/04/2013 | Inscription (CT) | XALKORI apporte une amélioration du service médical rendu modérée (niveau III) dans la stratégie de prise en charge du cancer bronchique non à petites cellules ALK+ au stade avancé en deuxième ligne et par rapport au docétaxel ou au pemetrexed. |