Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament n'appartient à aucun groupe générique
 Solution (Composition pour 1 ml de solution)
Solution (Composition pour 1 ml de solution)
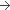 25 mg
25 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 28/02/2024 | Extension d'indication | Le service médical rendu par KEYTRUDA 25 mg/ml (pembrolizumab) en association au lenvatinib est important dans le traitement de 1ère ligne du carcinome rénal au stade avancé, uniquement à cellules claires ou comportant un contingent de cellules claires. |
| Insuffisant | Avis du 28/02/2024 | Extension d'indication | Le service médical rendu par KEYTRUDA 25 mg/ml (pembrolizumab) en association au lenvatinib est insuffisant pour justifier dune prise en charge par la solidarité nationale dans le traitement de première ligne, au stade avancé, du carcinome rénal avec une histologie autre quà cellules claires compte tenu de labsence de données robustes. |
| Important | Avis du 14/02/2024 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) 25 mg/ml, est important en association à une chimiothérapie à base de sels de platine et de fluoro-pyrimidine, dans le traitement de première ligne des patients adultes atteints dun adénocarcinome gastrique ou de la jonction ½sogastrique, localement avancé non résécable ou métastatique, HER-2 négatif et dont les tumeurs expriment PD-L1 avec un CPS = 10. |
| Insuffisant | Avis du 14/02/2024 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) 25 mg/ml, est insuffisant pour justifier dune prise en charge par la solidarité nationale dans les situations autres que celles retenues pour le remboursement. |
| Important | Avis du 18/01/2023 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) est important dans le carcinome rénal à cellules claires. |
| Insuffisant | Avis du 18/01/2023 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) est insuffisant dans le carcinome rénal non à cellules claires (chromophobe et tubulo-papillaire). |
| Important | Avis du 07/12/2022 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) est important dans l'indication : KEYTRUDA en monothérapie dans le traitement adjuvant des patients adultes et des adolescents âgés de 12 ans et plus atteints dun mélanome de stade IIB, IIC ayant eu une résection complète. |
| Important | Avis du 07/12/2022 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) est important dans l'indication : KEYTRUDA en monothérapie dans le traitement des patients [ ] et des adolescents âgés de 12 ans et plus atteints dun mélanome avancé (non résécable ou métastatique). |
| Important | Avis du 07/12/2022 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) est important dans l'indication : KEYTRUDA en monothérapie dans le traitement des patients [ ] et des adolescents âgés de 12 ans et plus atteints dun mélanome de stade III, ayant eu une résection complète. |
| Insuffisant | Avis du 04/01/2023 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) en monothérapie est insuffisant dans lensemble des indications. |
| Important | Avis du 14/12/2022 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) est important dans la nouvelle indication de lAMM. |
| Important | Avis du 14/09/2022 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) est important dans lindication de lAMM. |
| Important | Avis du 30/03/2022 | Extension d'indication | Le service médical rendu par KEYTRUDA dans le cadre de son association au lenvatinib est important dans lindication de lAMM. |
| Important | Avis du 06/04/2022 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) dans le cadre de son association à la chimiothérapie est important dans lindication de lAMM. |
| Important | Avis du 15/12/2021 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab)en association à une chimiothérapie à base de sels de platine et de fluoropyrimidine est important dans le traitement de première ligne des patients adultes atteints d'un cancer de l'oesophage, ou d'un adénocarcinome de la jonction gastro-oesophagienne HER-2 négatif uniquement de type I (classification Siewert), localement avancés non résécables ou métastatiques, dont les tumeurs expriment PD-L1 avec un CPS=10. |
| Insuffisant | Avis du 15/12/2021 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab)en association à une chimiothérapie à base de sels de platine et de fluoropyrimidine est insuffisant pour justifier dune prise en charge par la solidarité nationale dans le traitement de première ligne, des patients adultes atteints d'un adénocarcinome de la jonction gastro-½sophagienne HER-2 négatif, de type II ou III (classification Siewert) localement avancés non résécables ou métastatiques, dont les tumeurs expriment PD-L1 avec un CPS =10. |
| Important | Avis du 08/09/2021 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) est important dans lindication de lAMM. |
| Important | Avis du 02/06/2021 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) est important dans le traitement de première ligne des patients adultes atteints dun cancer colorectal métastatique avec une instabilité microsatellitaire élevée (MSI-H) ou une déficience du système de réparation des mésappariements de lADN (dMMR) non résécables demblée. |
| Insuffisant | Avis du 02/06/2021 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) est insuffisant pour justifier dune prise en charge par la solidarité nationale dans les autres situations (patients résécables demblée). |
| Important | Avis du 03/06/2020 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) est important dans le traitement de première ligne des patients adultes atteints dun carcinome épidermoïde des voies aérodigestives supérieures métastatique ou récidivant non résécable, dont les tumeurs expriment PD-L1 avec un CPS = 1 : - en monothérapie, - en association à la chimiothérapie. |
| Important | Avis du 13/05/2020 | Extension d'indication | Le service médical rendu par KEYTRUDA (pembrolizumab) en association à laxitinib est important dans le traitement de 1ère ligne, au stade avancé, du carcinome rénal uniquement à cellules claires ou comportant un contingent de cellules claires. |
| Important | Avis du 09/10/2019 | Extension d'indication | Le service médical rendu par KEYTRUDA est important dans lindication en association au carboplatine et au paclitaxel ou au nab-paclitaxel, dans le traitement de première ligne des patients adultes (statut de performance ECOG de 0 ou 1) atteints de CBNPC métastatique épidermoïde. |
| Important | Avis du 26/06/2019 | Extension d'indication | Le service médical rendu par KEYTRUDA est important dans lextension dindication : en monothérapie dans le traitement adjuvant des patients adultes atteints dun mélanome de stade III avec atteinte ganglionnaire, ayant eu une résection complète. |
| Commentaires | Avis du 05/06/2019 | Extension d'indication non sollicitée | La Commission prend acte du fait que le laboratoire ne demande pas linscription de la spécialité KEYTRUDA dans cette indication et rappelle que de ce fait cette spécialité nest pas agréée aux collectivités dans lindication : « en monothérapie dans le traitement des patients adultes atteints dun carcinome épidermoïde de la tête et du cou (HNSCC) récidivant ou métastatique dont les tumeurs expriment PD-L1 avec un TPS = 50 % et en progression pendant ou après une chimiothérapie à base de sels de platine. » |
| Important | Avis du 03/03/2021 | Nouvel examen suite au dépôt de nouvelles données | Le service médical rendu par KEYTRUDA (pembrolizumab) dans lindication : « KEYTRUDA (pembrolizumab) est indiqué en monothérapie dans le traitement des patients adultes atteints de cancer bronchique non à petites cellules localement avancé ou métastatique dont les tumeurs expriment PD-L1 avec un TPS = 1 %, et ayant reçu au moins une chimiothérapie antérieure. Les patients présentant des mutations tumorales dEGFR ou dALK doivent également avoir reçu une thérapie ciblée avant de recevoir KEYTRUDA (pembrolizumab) » reste important dans le traitement des patients adultes atteints d'un CBNPC localement avancé ou métastatique dont les tumeurs expriment PD-L1 avec un TPS ? 1 % après une chimiothérapie antérieure, les patients avec mutations activatrices de lEGFR devant également avoir reçu une thérapie ciblée. |
| Insuffisant | Avis du 03/03/2021 | Nouvel examen suite au dépôt de nouvelles données | Le service médical rendu par KEYTRUDA (pembrolizumab) dans lindication : « KEYTRUDA (pembrolizumab) est indiqué en monothérapie dans le traitement des patients adultes atteints de cancer bronchique non à petites cellules localement avancé ou métastatique dont les tumeurs expriment PD-L1 avec un TPS = 1 %, et ayant reçu au moins une chimiothérapie antérieure. Les patients présentant des mutations tumorales dEGFR ou dALK doivent également avoir reçu une thérapie ciblée avant de recevoir KEYTRUDA (pembrolizumab) » est insuffisant au regard des alternatives disponibles pour justifier dune prise en charge par la solidarité nationale dans le traitement des patients adultes atteints d'un CBNPC localement avancé ou métastatique, avec réarrangement du gène ALK, après une chimiothérapie antérieure. |
| Important | Avis du 20/02/2019 | Extension d'indication | Le service médical rendu par KEYTRUDA est important dans lextension dindication : en association à une chimiothérapie pemetrexed et sel de platine, dans le traitement de première ligne des patients adultes (statut de performance ECOG de 0 ou 1) atteints de CBNPC métastatique non-épidermoïde dont les tumeurs ne présentent pas de mutations dEGFR ou dALK. |
| Non précisé | Avis du 10/01/2018 | Extension d'indication non sollicitée | La Commission prend acte du fait que le laboratoire ne demande pas linscription de la spécialité KEYTRUDA dans cette indication et rappelle que de ce fait cette spécialité nest pas agréée aux collectivités dans lindication : « en monothérapie dans le traitement des patients adultes atteints dun carcinome urothélial localement avancé ou métastatique inéligibles à une chimiothérapie à base de cisplatine ». |
| Important | Avis du 21/02/2018 | Extension d'indication | Le service médical rendu par KEYTRUDA est important dans le « traitement des patients adultes atteints dun carcinome urothélial localement avancé ou métastatique ayant reçu une chimiothérapie antérieure à base de sels de platine ». |
| Important | Avis du 04/04/2018 | Extension d'indication | Le service médical rendu par KEYTRUDA est important dans lindication de lAMM « en monothérapie dans le traitement des patients adultes atteints dun lymphome de Hodgkin classique (LHc) en rechute ou réfractaire après échec dune greffe de cellules souches (GCS) autologue et dun traitement par brentuximab vedotin (BV), ou inéligibles à une greffe et après échec dun traitement par BV ». |
| Important | Avis du 05/07/2017 | Inscription (CT) | Le service médical rendu par KEYTRUDA 25 mg/ml, solution à diluer pour perfusion est important dans les trois indications de lAMM concernées. |
| Important | Avis du 17/05/2017 | Extension d'indication | Le service médical rendu par KEYTRUDA est important dans lextension dindication de lAMM « en monothérapie dans le traitement de première ligne des patients adultes atteints dun cancer bronchique non à petites cellules (CBNPC) métastatique dont les tumeurs expriment PD-L1 avec un score de proportion tumorale (TPS) =50 %, sans mutations tumorales dEGFR ou dALK ». |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Avis du 28/02/2024 | Extension d'indication | " Compte tenu : ? de la démonstration de la supériorité de lassociation KEYTRUDA (pembrolizumab) + lenvatinib par rapport au sunitinib, considéré comme un comparateur acceptable à la date de réalisation de létude KEYNOTE-581 (CLEAR), sur : la survie sans progression évaluée par un comité de revue indépendant (critère de jugement principal) : 23,9 mois vs. 9,2 mois en médiane . HR=0,39 IC95% [0,32 . 0,49] . p<0,0001 la survie globale (critère de jugement secondaire hiérarchisé) : la médiane na été atteinte dans aucun des deux groupes . HR = 0,66 . IC95% [0,49 . 0,88] . p=0,0049, malgré : ? un surcroît de toxicité de cette association par rapport au sunitinib en termes notamment dévénements indésirables graves (50,6% versus 33,2%), de grades = 3 (82,4% versus 71,8%) ou entrainant larrêt du traitement (37,4% versus 14,4%), ? des données de qualité de vie exploratoires, la Commission de la Transparence considère que lassociation KEYTRUDA (pembro-lizumab) + lenvatinib appo |
|
| Avis du 14/02/2024 | Extension d'indication | " Compte-tenu : ? de la démonstration dune supériorité dans une étude de phase III, en double aveugle de KEYTRUDA (pembrolizumab) en association à une chimiothérapie à base de sels de platine et de fluoropyrimidine par rapport à la chimiothérapie seule chez les patients dont les tumeurs expriment PD-L1 avec un CPS = 10 en termes de : survie globale : HR = 0,65 (IC95% [0,53 . 0,79] . p<0,0001) . survie sans progression : HR = 0,62 (IC95% [0,51 . 0,76] . p < 0,0001) et malgré : ? un profil de tolérance de KEYTRUDA (pembrolizumab) en association à la chimiothérapie moins favorable que la chimiothérapie seule, marqué notamment par des effets indésirables à médiation immunitaire (principalement une dysthyroïdie), ? labsence de donnée robuste sur la qualité de vie, la Commission de la Transparence considère que KEYTRUDA (pembrolizumab) en association à une chimiothérapie à base de fluoropyrimidine et de sels de platine, traitement de première ligne des patients adultes atteints dun ad |
|
| Avis du 18/01/2023 | Extension d'indication | Compte tenu : - dune démonstration de supériorité du pembrolizumab versus placebo sur le critère principal, survie sans maladie évaluée par linvestigateur, avec un HR = 0,68 (IC95% : [0,53 - 0,87]), p=0,0010 . - de labsence de démonstration de supériorité du groupe pembrolizumab par rapport au groupe en termes de survie globale (p=NS) et des données immatures à ce jour . - dun surcroit de toxicité dans le groupe pembrolizumab, notamment marqué par des événements indésirables de grade supérieur ou égal à 3 (32,2% versus 17,7%) et des évènements indésirables graves (20,7% versus 11,5%) . - dune absence dimpact démontrée sur la qualité de vie (critère exploratoire) . la Commission considère quen létat actuel du dossier, KEYTRUDA (pembrolizumab) apporte une amélioration du service médical rendu mineure (ASMR IV) en monothérapie dans le traitement adjuvant des adultes atteints dun carcinome rénal à cellules claires à risque accru de récidive post néphrectomie, ou après une néphrectomie et u |
|
| Avis du 07/12/2022 | Extension d'indication | KEYTRUDA (pembrolizumab) apporte une amélioration du service médical rendu mineure (ASMR IV) en monothérapie dans le traitement adjuvant des adultes et adolescents âgés de 12 ans et plus, atteints dun mélanome de stade IIB, IIC ayant eu une résection complète. KEYTRUDA (pembrolizumab) apporte chez ladolescent au même titre que chez ladulte une amélioration du service médical rendu mineure (ASMR IV) dans le traitement du mélanome au stade avancé (mélanome non résécable ou métastatique). |
|
| Avis du 07/12/2022 | Extension d'indication | KEYTRUDA (pembrolizumab) apporte chez ladolescent au même titre que chez ladulte une amélioration du service médical rendu mineure (ASMR IV) dans le traitement du mélanome au stade avancé (mélanome non résécable ou métastatique). | |
| Avis du 07/12/2022 | Extension d'indication | Compte tenu : - dune prise en charge considérée comme similaire entre ladulte et ladolescent, - de lextrapolation aux adolescents des résultats de lévaluation du pembrolizumab chez ladulte aux stades III résécable et avancés (mélanome non résécable ou métastatique), - des données de tolérance issues de létude KEYNOTE-051, la Commission considère que KEYTRUDA (pembrolizumab) apporte chez ladolescent au même titre que chez ladulte une amélioration du service médical rendu modérée (ASMR III) dans le traitement du mélanome au stade III résécable. |
|
| Avis du 14/12/2022 | Extension d'indication | " Prenant en compte une démonstration dans une étude randomisée en double aveugle : ¿ dune supériorité du pembrolizumab sur les co- critères principaux : réponse histologique complète (64,8% dans le groupe pembrolizumab versus 51,2% dans le groupe placebo) et survie sans événement avec un HR de 0,63 (IC95% : [0,48 . 0,82]), ¿ de limpossibilité de tirer de conclusion sur un effet sur la survie globale du fait de limmaturité des données disponibles (critère secondaire hiérarchisé) ou sur a qualité de vie (critère explo-ratoire), ¿ de lincidence des événements indésirables graves (EIG) plus élevée dans le groupe pembrolizumab + chimiothérapie / pembrolizumab comparée au groupe placebo + chimiothérapie / placebo (43,6% et 28,5% respectivement), la Commission considère quen létat actuel du dossier, KEYTRUDA (pembrolizumab) apporte une amélioration du service médical rendu mineure (ASMR IV) dans le traitement néoadjuvant puis adjuvant des patients adultes atteints d'un cancer du sein triple négati |
|
| Avis du 14/09/2022 | Extension d'indication | Compte-tenu : - de la démonstration dans une étude de phase III, randomisée, en double aveugle, de la supériorité de lassociation KEYTRUDA (pembrolizumab) et chimiothérapie (sel de platine, paclitaxel ± beva-cizumab) par rapport à la chimiothérapie seule, notamment en termes de : - survie sans progression (gain de 2,2 mois . HR = 0,62 . IC95% : [0,50 . 0,77]) - survie globale avec une médiane non atteinte dans le groupe pembrolizumab versus 16,3 mois (HR = 0,64 ([0,50 . 0,81]). - Un profil de tolérance déjà connu du KEYTRUDA (pembrolizumab) avec des incidences dEI proches entre les deux groupes de traitement . Et malgré labsence de conclusion formelle pouvant être tirée des résultats de qualité de vie, KEYTRUDA, en association à une chimiothérapie, apporte une amélioration du service médi-cal rendu modérée (ASMR III) dans le traitement de première ligne des patientes adultes at-teintes dun cancer du col de lutérus persistant, récidivant ou métastatique, dont les tumeurs expriment PD-L |
|
| Avis du 30/03/2022 | Extension d'indication | KEYTRUDA en association à LENVIMA (lenvatinib) apporte une amélioration du service médical rendu modérée (ASMR III) par rapport à une monochimiothérapie par doxorubicine ou docétaxel dans le traitement de deuxième ligne des patientes adultes atteintes dun cancer de lendomètre avancé ou récidivant, dont la maladie progresse pendant ou après un traitement antérieur à base de sels de platine et qui ne sont pas éligibles à une chirurgie curative ou à une radiothérapie. | |
| Avis du 06/04/2022 | Extension d'indication | KEYTRUDA, en association à une chimiothérapie, apporte une amélioration du service médical rendu modérée (ASMR III) par rapport à la chimiothérapie seule dans le traitement de première ligne des patients adultes atteints dun cancer du sein triple négatif localement récurrent non résécable ou métastatique, dont les tumeurs expriment PD-L1 avec un CPS = 10. | |
| Avis du 15/12/2021 | Extension d'indication | La Commission de la Transparence considère que KEYTRUDA (pembrolizumab) en association à une chimiothérapie à base de sels de platine et de fluoropyrimidine apporte une amélioration du service médical rendu modérée (ASMR III) par rapport à la chimiothérapie seule dans le traitement de 1ère ligne du cancer de l½sophage ou d'un adénocarcinome de la jonction gastro-½sophagienne HER-2 négatif de type I (classification Siewert), localement avancés non résécables ou métastatiques, dont les tumeurs expriment PD-L1 avec un CPS =10. | |
| Avis du 08/09/2021 | Extension d'indication | Compte tenu : - de la démonstration de la supériorité de KEYTRUDA (pembrolizumab) en monothérapie par rapport au brentuximab vedotin en monothérapie en termes de survie sans progression avec un gain absolu estimé de 4,9 mois et un HR=0,65 [IC95% : 0,48-0,88], considéré comme cliniquement pertinent dans une étude de phase III randomisée en ouvert ayant inclus des patients en 3ème ligne et plus . et malgré : - labsence de démonstration dun gain en survie globale (données immatures) . - labsence de conclusion formelle pouvant être tirée des résultats de qualité de vie . - labsence de données comparatives chez lenfant de 3 ans et plus, mais pour lesquels la Commission souligne leffort de développement pédiatrique dans cette maladie . la Commission de la Transparence considère que KEYTRUDA (pembrolizumab) en monothérapie apporte une amélioration du service médical rendu mineure (ASMR IV) par rapport au brentuximab vedotin chez les enfants de 3 ans et plus et les adultes atteints dun lympho |
|
| Avis du 02/06/2021 | Extension d'indication | " Dans le périmètre du remboursement : Compte tenu : - de la démonstration de la supériorité de KEYTRUDA (pembrolizumab) en monothérapie par rapport à une chimiothérapie standard ± thérapie ciblée, en termes de survie sans progression : augmentation en moyenne de 2,9 mois [IC95% : 0,7-5,1] au cours des 24 premiers mois de suivi, dans une étude de phase III randomisée en-ouvert et, - du profil de tolérance marqué par une fréquence moins importante dévénements indésirables de grades 3-5 et dévénements indésirables graves, et une fréquence plus importante dévénements indésirables dintérêt particulier (identifiés comme risques importants dans le PGR) . et malgré : - labsence de démonstration dun gain en survie globale sur une analyse intermédiaire prévue au protocole . - labsence de conclusion formelle pouvant être tirée des résultats de qualité de vie . la Commission de la Transparence considère que KEYTRUDA (pembrolizumab) en monothérapie apporte une amélioration du service médi |
|
| Avis du 03/06/2020 | Extension d'indication | " Compte tenu : - de la démonstration de la supériorité de KEYTRUDA (pembrolizumab) en monothérapie par rapport au protocole EXTREME, considéré comme un comparateur acceptable, sur la survie globale (critère de jugement principal) avec un gain absolu de 2 mois dans cette population (HR = 0,78 . IC95% = [0,64 . 0,96] . p=0,00855 < seuil de 0,0109) - du profil de tolérance favorable de cette monothérapie par rapport au protocole EXTREME, et malgré : - labsence de démonstration dun bénéfice sur la survie sans progression (critère de jugement principal), - labsence de donnée de qualité de vie à valeur démonstrative, KEYTRUDA en monothérapie apporte une amélioration de service médicale rendu modérée (ASMR III) par rapport au protocole EXTREME chez les patients dont les tumeurs expriment le PD-L1 avec un CPS = 1. " |
|
| Avis du 03/06/2020 | Extension d'indication | " Compte tenu : - de la démonstration de la supériorité de lassociation KEYTRUDA (pembrolizumab) + chimiothérapie à base de platine et 5-FU par rapport au protocole EXTREME, considéré comme un comparateur acceptable sur la survie globale (critère de jugement principal) avec un gain absolu de 3,2 mois dans cette population (HR = 0,65 . IC 95% = [0,53 . 0,80]. p=0.00002 < seuil de 0,0026) - dun surcroit de toxicité dans le cadre de son association à la chimiothérapie notamment lincidence des EI graves (59,8% versus 49,1%) - de labsence de démonstration dun bénéfice sur la survie sans progression (critère de jugement principal) - et de labsence de donnée de qualité de vie à valeur démonstrative, KEYTRUDA en association à la chimiothérapie à base de platine et 5-FU apporte une amélioration de service médicale rendu mineure (ASMR IV) par rapport au protocole EXTREME chez les patients dont les tumeurs expriment le PD-L1 avec un CPS = 1. " |
|
| Avis du 13/05/2020 | Extension d'indication | " Compte tenu : - de la démonstration de la supériorité de lassociation KEYTRUDA (pembrolizumab) à laxitinib par rapport au sunitinib, considéré comme un comparateur acceptable, sur les deux critères de jugement principaux lors dune analyse intermédiaire et avec un court suivi médian de 12,8 mois : la survie sans progression évaluée par un comité indépendant (15,1 mois vs 11,1 mois en médiane . HR=0,69 IC95% [0,57 . 0,84], p= 0,00014), la survie globale : HR=0,53 IC95% [0,38 . 0,74] . p=0,00005, avec néanmoins une incertitude pour le sous-groupe à pronostic favorable, malgré : - le surcroît de toxicité de cette association par rapport au sunitinib avec notamment une fréquence plus élevée dévénements indésirables graves (40,3% vs 31,3%), de grades = 3 (75,8% vs 70,6%) ou entrainant larrêt du traitement (30,5% vs 13,9%), - labsence de donnée de qualité de vie à valeur démonstrative, - des incertitudes notamment sur la contribution respective de chacun des composants de lassoc |
|
| Avis du 09/10/2019 | Extension d'indication | " Compte-tenu, - de la démonstration de la supériorité de lassociation pembrolizumab (KEYTRUDA) plus chimiothérapie par carboplatine et paclitaxel ou nab-paclitaxel par rapport à cette même chimiothérapie administrée seule en termes de survie sans progression et de survie globale (co-critères de jugement principaux) lors dune analyse intermédiaire prévue au protocole, - du gain en survie globale important (+ 4,6 mois), observé lors dune analyse intermédiaire à lissue dun suivi médian de 8,3 mois dans le groupe pembrolizumab et 7,4 mois dans le groupe placebo, - de la transposabilité limitée des données de létude KEYNOTE-407 à la population française compte-tenu du fait que 40 % des patients aient reçu lassociation nab-paclitaxel + carboplatine, non citée par les recommandations nationales, - de labsence de donnée robuste de qualité de vie, KEYTRUDA, en association à une chimiothérapie par carboplatine et paclitaxel ou nab-paclitaxel, apporte une amélioration du service médical rendu mod |
|
| Avis du 26/06/2019 | Extension d'indication | " Prenant en compte : - la démonstration de la supériorité de KEYTRUDA par rapport à un placebo sur la réduction du risque de récidive (médiane de survie sans récidive (critère de jugement principal) de 20,4 mois dans le groupe placebo et non atteinte dans le groupe pembrolizumab) chez les patients atteints dun mélanome cutané de stade III, après résection complète, - limmaturité des données de survie globale pour conclure sur un avantage de KEYTRUDA par rapport au placebo sur ce critère de jugement, - le profil de toxicité du pembrolizumab (EI de grades = 3 : 31% dans le groupe pembrolizumab et de 19,1% dans le groupe placebo), - le besoin médical important dans ce contexte compte tenu du risque de récidive élevé en cas datteinte ganglionnaire même après résection complète et de la faible efficacité du comparateur historique (interféron), KEYTRUDA apporte comme OPDIVO une amélioration du service médical rendu modérée (ASMR III) dans la stratégie thérapeutique. " |
|
| Avis du 03/03/2021 | Nouvel examen suite au dépôt de nouvelles données | Dans le périmètre du remboursement à savoir dans lindication de lAMM à lexception du CBNPC avancé avec réarrangement ALK (ALK+) : Les données disponibles ne sont pas de nature à modifier lappréciation de la Commission, KEYTRUDA (pembrolizumab) apporte une amélioration du service médical rendu mineure (ASMR IV) par rapport au docétaxel dans le traitement du CBNPC localement avancé ou métastatique dont les tumeurs expriment PD-L1 avec un TPS = 1 % après échec dau moins une chimiothérapie antérieure. Les patients avec mutations activatrices de lEGFR devant également avoir reçu une thérapie ciblée avant de recevoir KEYTRUDA (pembrolizumab). |
|
| Avis du 20/02/2019 | Extension d'indication | " Compte tenu : - dune démonstration dune supériorité de lassociation pembrolizumab (KEYTRUDA) plus chimiothérapie par pemetrexed et sel de platine par rapport à cette même chimiothérapie administrée seule en termes de survie sans progression ainsi quen survie globale, observée lors dune analyse intermédiaire, - dun surcroît de toxicité de cette association par rapport à la chimiothérapie seule notamment des arrêts de traitement pour événements indésirables notés chez près dun patient sur trois dans létude, KEYTRUDA en association à une chimiothérapie par pemetrexed et sel de platine apporte une amélioration du service médical rendu modérée (ASMR III) en termes defficacité par rapport à la chimiothérapie par pemetrexed et sel de platine, en traitement de première ligne des patients adultes (statut de performance ECOG de 0 ou 1) atteints de CBNPC métastatique non-épidermoïde dont les tumeurs ne présentent pas de mutations dEGFR ou dALK. " |
|
| Avis du 21/02/2018 | Extension d'indication | " Prenant en compte : - la démonstration de la supériorité de KEYTRUDA par rapport à la chimiothérapie sur la survie globale (gain absolu de 2,9 mois), - labsence de donnée robuste de qualité de vie dans cette étude réalisée en ouvert, - le risque plus élevé de décès dans les deux premiers mois de traitement par rapport à la chimiothérapie observé dans cette étude, la Commission considère que KEYTRUDA apporte une amélioration du service médical rendu mineure (ASMR IV) par rapport à la chimiothérapie dans le traitement du carcinome urothélial localement avancé ou métastatique après échec dau moins une chimiothérapie antérieure à base de sels de platine. " |
|
| V (Inexistant) | Avis du 04/04/2018 | Extension d'indication | " Compte tenu : - des données defficacité très limitées issues dune phase II non comparative, multicohortes, en cours, montrant un pourcentage de réponse objective compris entre 66,7 et 75,4% avec un suivi médian de 15,9 mois, - du nombre de cas de réactions du greffon contre l'hôte et de la mortalité faisant suite à lallogreffe de cellules souches, plus élevé quattendu, chez des patients recevant une allogreffe après un traitement par pembrolizumab, - du besoin médical important chez les patients en rechutes multiples ou réfractaires, la Commission considère que KEYTRUDA napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie de prise en charge des patients adultes atteints dun lymphome de Hodgkin classique (LHc) en rechute ou réfractaire : - après échec dune greffe de cellules souches (GCS) autologue et dun traitement par brentuximab vedotin (BV), comme OPDIVO, - ou inéligibles à une greffe et après échec dun traitement par BV. La stratégie de prise en c |
| V (Inexistant) | Avis du 05/07/2017 | Inscription (CT) | Cette spécialité est un complément de gamme qui napporte pas damélioration du service médical rendu (ASMR V) par rapport à KEYTRUDA 50 mg poudre pour solution à diluer pour perfusion. |
| Avis du 17/05/2017 | Extension d'indication | KEYTRUDA apporte une amélioration du service médical rendu modérée (ASMR III) par rapport à la bithérapie à base de sels de platine en première ligne de traitement du cancer bronchique non à petites cellules métastatique et dont les tumeurs expriment PD-L1 avec un score de proportion tumorale (TPS) =50% et ne présentent pas de mutation tumorale dEGFR ou dALK. |