Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament n'appartient à aucun groupe générique
 Solution (Composition pour 1 ml de solution)
Solution (Composition pour 1 ml de solution)
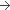 10 mg
10 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Commentaires | Avis du 27/05/2020 | Extension d'indication non sollicitée | La Commission prend acte du fait que le laboratoire LILLY FRANCE ne demande pas linscription de la spécialité CYRAMZA 10 mg/mL (ramucirumab) dans cette indication et rappelle que de ce fait cette spécialité nest pas remboursable dans lindication : « CYRAMZA (ramucirumab) en monothérapie est indiqué dans le traitement des patients adultes atteints dun carcinome hépatocellulaire avancé ou non résécable avec une alpha-foetoprotéine sérique = 400 ng/mL et ayant été antérieurement traités par sorafénib ». |
| Faible | Avis du 01/04/2020 | Extension d'indication | Le service médical rendu par CYRAMZA (ramucirumab) est faible dans cette extension dindication de lAMM. |
| Non précisé | Avis du 05/10/2016 | Extension d'indication non sollicitée | La Commission prend acte du fait que le laboratoire ne demande pas linscription de la spécialité CYRAMZA dans cette indication et rappelle que de ce fait cette spécialité nest pas remboursable dans lindication : « en association avec le docétaxel, dans le traitement des patients adultes atteints dun cancer bronchique non à petites cellules localement avancé ou métastatique dont la maladie a progressé après une chimiothérapie à base de sels de platine ». |
| Modéré | Avis du 21/09/2016 | Extension d'indication | Le service médical rendu par CYRAMZA est modéré dans lindication traitement de 2ème ligne du cancer colorectal métastatique. |
| Insuffisant | Avis du 17/06/2015 | Inscription (CT) | Le service médical rendu par CYRAMZA est insuffisant en monothérapie pour une prise en charge par la solidarité nationale dans le traitement des patients adultes atteints d'un cancer gastrique ou d'un adénocarcinome de la jonction gastro-oesophagienne avancés dont la maladie a progressé après une chimiothérapie à base de sels de platine ou de fluoropyrimidine et pour lesquels un traitement en association avec le paclitaxel nest pas approprié. |
| Modéré | Avis du 17/06/2015 | Inscription (CT) | Le service médical rendu par CYRAMZA est modéré en association avec le paclitaxel, dans le traitement des patients adultes atteints dun cancer gastrique ou dun adénocarcinome de la jonction gastro-oesophagienne avancés dont la maladie a progressé après une chimiothérapie à base de sels de platine et de fluoropyrimidine, associée au trastuzumab en cas de surexpression HER2. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 01/04/2020 | Extension d'indication | " Compte tenu : - de la démonstration dune supériorité de lassociation ramucirumab + erlotinib par rapport à lerlotinib seul en termes de survie sans progression (gain évalué par linvestigateur à 7 mois, HR = 0,591 (IC95% = [0,461-0,760]), p<0,0001 et par le comité de relecture indépendant à 5,4 mois, HR = 0,671 (IC95% = [0,518-0,869]), p=0,0022) . - de labsence de gain démontré en survie globale (immaturité des données lors de lanalyse intermédiaire) . - de labsence de conclusion formelle pouvant être tirée des résultats de qualité de vie . - du profil de toxicité marqué principalement par une incidence plus importante des évènements indésirables liés au traitement de grades 3 ou plus (infections) avec lassociation ramucirumab+ erlotinib . la Commission considère que CYRAMZA (ramucirumab) napporte pas une amélioration du service médical rendu (ASMR V) en association avec lerlotinib dans le traitement de première ligne des patients adultes atteints dun cancer bronchique non à petites |
| V (Inexistant) | Avis du 21/09/2016 | Extension d'indication | Compte tenu : -de labsence de donnée comparative versus les thérapies ciblées disponibles (bevacizumab et cetuximab), -de leffet significatif mais modeste de CYRAMZA sur la survie globale et la survie sans progression démontré versus placebo, -du besoin médical partiellement couvert dans le cancer colorectal métastatique, -de labsence damélioration de la qualité de vie par rapport au placebo, la Commission considère que CYRAMZA, en association à la chimiothérapie FOLFIRI, napporte pas damélioration du service médicale rendu (ASMR V), dans la prise en charge du cancer colorectal métastatique en progression pendant ou après traitement par bévacizumab, oxalipaltine et une fluoropyrimidine. |
| V (Inexistant) | Avis du 17/06/2015 | Inscription (CT) | Compte tenu de la faiblesse du bénéfice clinique démontré en association au paclitaxel, la Commission considère que les spécialités CYRAMZA napportent pas damélioration du service médical rendu (ASMR V) dans la prise en charge (cf paragraphe 06) des patients atteints dun cancer gastrique ou dun adénocarcinome de la jonction gastro-oesophagienne avancés dont la maladie a progressé après une chimiothérapie de première ligne à base de sels de platine et de fluoropyrimidine. |