Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament n'appartient à aucun groupe générique
 Comprimé (Composition pour Un comprimé)
Comprimé (Composition pour Un comprimé)
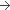 45 mg
45 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Commentaires | Avis du 15/05/2019 | Autre demande | " La population cible totale dICLUSIG est estimée à un maximum de 1 740 patients, avec : - un maximum de 1 400 patients avec une LMC toutes phases confondues, précédemment traités par un ou plusieurs inhibiteurs de la tyrosine kinase et pour lesquels l'imatinib, le nilotinib et le dasatinib ne sont pas considérés comme des traitements appropriés, en labsence de la mutation T315l . - un maximum de 60 patients avec une LAL Ph+ en cas de résistance ou dintolérance au dasatinib et lorsquun traitement ultérieur par imatinib n'est pas cliniquement approprié en labsence de mutation T315l . - un maximum de 280 patients avec une LMC tous stades confondus ou une LAL Ph+ et ayant développé une mutation T315I. " |
| Important | Avis du 21/01/2015 | Inscription (CT) | Le service médical rendu par ICLUSIG est important dans le traitement de la leucémie myéloïde chronique (LMC) en phase chronique, en phase accélérée ou en phase blastique qui présentent une résistance au dasatinib ou au nilotinib ou une intolérance au dasatinib ou au nilotinib et pour qui un traitement ultérieur par imatinib n'est pas cliniquement approprié, ou qui expriment la mutation T315I. Le service médical rendu par ICLUSIG est important dans le traitement de la leucémie aiguë lymphoblastique à chromosome Philadelphie (LAL Ph+) qui présentent une résistance au dasatinib ou une intolérance au dasatinib et pour qui un traitement ultérieur par imatinib n'est pas cliniquement approprié, ou qui expriment la mutation T315I. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Avis du 21/01/2015 | Inscription (CT) | En labsence de mutation T315I, ICLUSIG apporte une amélioration du service médical rendu mineure (ASMR IV) dans la stratégie thérapeutique actuelle de la LAL Ph+ en cas de résistance ou dintolérance au dasatinib et lorsquun traitement ultérieur par imatinib n'est pas cliniquement approprié. | |
| V (Inexistant) | Avis du 21/01/2015 | Inscription (CT) | En labsence de mutation T315I, ICLUSIG napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique actuelle de la LMC, toutes phases, chez les patients précédemment traités par un ou plusieurs inhibiteurs de la tyrosine kinase et pour lesquels l'imatinib, le nilotinib et le dasatinib ne sont pas considérés comme des traitements appropriés. |
| Avis du 21/01/2015 | Inscription (CT) | En présence de la mutation T315I, ICLUSIG apporte une amélioration du service médical rendu modérée (ASMR III) en termes defficacité chez les patients ayant une LMC, toutes phases, ou une LAL Phi+. |