Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament appartient au(x) groupe(s) générique(s) suivants :
 Comprimé (Composition pour Un comprimé)
Comprimé (Composition pour Un comprimé)
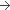 40 mg
40 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 15/02/2023 | Réévaluation SMR et ASMR | Le service médical rendu par XTANDI (enzalutamide) est important dans lindication de lAMM. |
| Important | Avis du 21/07/2021 | Extension d'indication | Le service médical rendu par XTANDI (enzalutamide) est important dans lindication de lAMM. |
| Important | Avis du 12/06/2019 | Extension d'indication | Le service médical rendu par XTANDI en association à lADT est important dans le traitement des hommes adultes atteints dun cancer de la prostate résistant à la castration non métastatique avec un risque élevé de développer une maladie métastatique, défini par un temps de doublement de lantigène spécifique de la prostate (PSADT) = 10 mois. |
| Important | Avis du 25/07/2018 | Inscription (CT) | Le service médical rendu par XTANDI 40 mg, comprimé pelliculé est important dans les indications de lAMM. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Avis du 15/02/2023 | Réévaluation SMR et ASMR | La Commission accorde à XTANDI (enzalutamide) en association à lADT, comme pour ZYTIGA (acétate dabiratérone) et ERLEADA (apalutamide), une amélioration du service médical rendu modérée (ASMR III) versus ADT seule, dans le traitement des hommes adultes atteints dun cancer de la prostate métastatique hormonosensible en association avec lADT. | |
| Avis du 21/07/2021 | Extension d'indication | Compte-tenu dune part : - de la démonstration dun gain en termes de survie globale de lassociation enzalutamide + ADT versus ADT seule dans une seule des deux études fournies (létude ouverte ENZAMET, HR = 0,67 . IC95% = [0,52 . 0,86]) mais non confirmé à ce stade dans la 2ème étude de phase III randomisée en double aveugle (létude ARCHES), - de la supériorité en termes de survie sans progression radiologique (15,5 % versus 34,4 % . HR = 0,39, IC95% = [0,30 . 0,50]) démontrée dans létude ARCHES, - du profil de tolérance de XTANDI (enzalutamide) en association à lADT jugé acceptable par rapport à lassociation placebo + ADT avec respectivement 23,6 % et 24,7 % dévénements indésirables de grades = 3, mais considérant dautre part : - lincertitude liée à la non-disponibilité des résultats de lanalyse finale de létude ARCHES dans un contexte où lanalyse intermédiaire date doctobre 2018 et, - labsence de démonstration dune amélioration de la qualité de vie, la Commission de la Tr |
|
| Avis du 12/06/2019 | Extension d'indication | " Compte-tenu : - de la démonstration de la supériorité de XTANDI par rapport au placebo, tous deux en association à la suppression androgénique (ADT), en termes de délai de survie sans métastase (critère de jugement principal) avec une quantité deffet supplémentaire importante correspondant à un gain absolu de près de 22 mois, - de la supériorité démontrée en termes de temps jusquà progression du PSA et de temps médian jusquà lutilisation de nouveaux traitement anticancéreux (critères de jugements secondaires hiérarchisés), - de labsence de démonstration dun gain en survie globale, critère de jugement secondaire hiérarchisé, compte-tenu du nombre limité dévénements à ce stade de la maladie (HR = 0,83 (IC 95 % [0,65 . 1,06]), - du profil de tolérance de XTANDI en association à lADT par rapport à lassociation placebo plus ADT avec respectivement 31,4% et 23,4% dévénements indésirables de grades = 3, la Commission considère que XTANDI, comme ERLEADA, en association à lADT apporte une |
|
| V (Inexistant) | Avis du 25/07/2018 | Inscription (CT) | Cette spécialité est un complément de gamme qui napporte pas damélioration du service médical rendu (ASMR V) par rapport à la présentation existante. |