Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament n'appartient à aucun groupe générique
 Poudre (Composition pour Un flacon)
Poudre (Composition pour Un flacon)
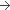 10 mg
10 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 06/10/2021 | Réévaluation SMR et ASMR | Le service médical rendu par CABLIVI (caplacizumab) est important dans le traitement des patients adultes présentant un épisode de purpura thrombotique thrombocytopénique acquis (PTTa) conjointement à un traitement par échanges plasmatiques et par immunosuppresseurs. |
| Insuffisant | Avis du 06/10/2021 | Réévaluation SMR et ASMR | Le service médical rendu par CABLIVI (caplacizumab) est insuffisant dans lextension dindication de lAMM, à savoir le traitement des patients adolescents de plus de 12 ans et de plus de 40 kg présentant un épisode de purpura thrombotique thrombocytopénique acquis (PTTa) conjointement à un traitement par échanges plasmatiques et par immunosuppresseurs. |
| Insuffisant | Avis du 06/10/2021 | Extension d'indication | Le service médical rendu par CABLIVI (caplacizumab) est insuffisant dans lextension dindication de lAMM, à savoir le traitement des patients adolescents de plus de 12 ans et de plus de 40 kg présentant un épisode de purpura thrombotique thrombocytopénique acquis (PTTa) conjointement à un traitement par échanges plasmatiques et par immunosuppresseurs. |
| Important | Avis du 10/04/2019 | Inscription (CT) | Le service médical rendu par CABLIVI est important dans lindication de lAMM. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Avis du 06/10/2021 | Réévaluation SMR et ASMR | La Commission estime que CABLIVI (caplacizumab), en association au traitement standard de lépisode de PTTa comprenant les échanges plasmatiques associés aux immunosuppresseurs, apporte une amélioration du service médical rendu mineure (ASMR IV) par rapport au traitement standard. | |
| Avis du 10/04/2019 | Inscription (CT) | " Compte tenu : - de la démonstration de la supériorité de CABLIVI (caplacizumab) par rapport au placebo, tous deux associés aux échanges plasmatiques (EP) et à des immunosuppresseurs, dans une étude randomisée, en double aveugle, uniquement sur un critère de jugement biologique, à savoir le délai jusqu'à la normalisation du taux de plaquettes (critère de jugement principal), - avec une quantité d'effet supplémentaire jugée modeste (différence de médianes de 4 heures 30 minutes, HR=1,55 [1,095 . 2,195]. p=0,0099), - de la démonstration de la supériorité de CABLIVI par rapport au placebo sur un des critères de jugement secondaires hiérarchisés, à savoir le pourcentage de patients présentant une récidive de l'épisode de PTTa (exacerbation ou rechute tardive) (12,7% versus 38,4% . p<0,001), ce qui est cliniquement pertinent, - mais de l'absence de démonstration d'un effet de CABLIVI par rapport au placebo, tous deux associés aux échanges plasmatiques et à des immunosuppresseurs, sur d'autres critères |