Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.

Ce médicament n'appartient à aucun groupe générique
 Comprimé (Composition pour Un comprimé)
Comprimé (Composition pour Un comprimé)
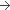 150 mg
150 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 11/05/2022 | Extension d'indication | Le service médical rendu par lassociation KAFTRIO (ivacaftor / tezacaftor / elexacaftor) + KALYDECO (ivacaftor) est important dans lindication du traitement des patients atteints de mucoviscidose âgés de 6 ans et plus porteurs dau moins une mutation F508del du gène CFTR (cystic fibrosis transmembrane conductance regulator). |
| Important | Avis du 27/10/2021 | Extension d'indication | Le service médicalrendu par KAFTRIO (ivacaftor/tezacaftor/elexacaftor) en association avec KALYDECO (ivacaftor) est important dans lextension dindication de lAMM. |
| Important | Avis du 13/10/2021 | Réévaluation suite à résultats étude post-inscript | La Commission considère que le service médical rendu par KALYDECO (ivacaftor) reste important dans lindication de lAMM. |
| Important | Avis du 07/07/2021 | Extension d'indication | Le service médical rendu par SYMKEVI (tezacaftor/ivacaftor) en association avec KALYDECO (ivacaftor) est important dans lextension dindication de lAMM de SYMKEVI (tezacaftor/ivacaftor) 100 mg/150 mg, comprimé pelliculé et de KALYDECO (ivacaftor) 150 mg, comprimé pelliculé et dans lindication de lAMM de SYMKEVI (tezacaftor/ivacaftor) 50 mg/75 mg, comprimé pelliculé et de KALYDECO (ivacaftor) 75 mg, comprimé pelliculé. |
| Important | Avis du 05/11/2014 | Extension d'indication | Le service médical rendu par KALYDECO est important dans lextension dindication de lAMM « traitement de la mucoviscidose chez les patients âgés de 6 ans et plus, porteurs de lune des mutations de défaut de régulation (classe III) du gène CFTR suivantes : G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N ou S549R ». |
| Important | Avis du 05/11/2014 | Inscription (CT) | Le service médical rendu par KALYDECO 150 mg, comprimé pelliculé, plaquette thermoformée est important dans le traitement de la mucoviscidose chez les patients âgés de 6 ans et plus et porteurs de lune des mutations de défaut de régulation (classe III) du gêne CFTR suivantes: G551D, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N ou S549R. |
| Important | Avis du 07/11/2012 | Inscription (CT) | Le service médical rendu par KALYDECO est important dans l'indication de l'AMM. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Avis du 11/05/2022 | Extension d'indication | KAFTRIO (ivacaftor/tezacaftor/elexacaftor) en association avec KALYDECO (ivacaftor) apporte : - une amélioration du service médical rendu importante (ASMR II) dans la prise en charge thérapeutique de la mucoviscidose des patients âgés de 6 à 11 ans homozygotes pour la mutation F508del du gène CFTR ou hétérozygotes pour la mutation F508del du gène CFTR et porteurs dune mutation du gène CFTR à fonction minimale. |
|
| Avis du 11/05/2022 | Extension d'indication | KAFTRIO (ivacaftor/tezacaftor/elexacaftor) en association avec KALYDECO (ivacaftor) apporte : - une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge thérapeutique de la mucoviscidose des patients âgés de 6 ans à 11 ans hétérozygotes pour la mutation F508del du gène CFTR et porteurs dune mutation à fonction résiduelle ou dune mutation dite « gating ». |
|
| Avis du 27/10/2021 | Extension d'indication | Compte tenu : - de la démonstration dun bénéfice cliniquement pertinent de KAFTRIO (ivacaftor/tezacaftor/elexacaftor) en association avec KALYDECO (ivacaftor) dans une étude randomisée en double aveugle, contrôlée par rapport aux comparateurs cliniquement pertinents (ivacaftor ou tezacaftor/ivacaftor) en termes damélioration du VEMS à la semaine 8 (différence moyenne intra-groupe de +3,7 points, IC95% [2,8 . 4,6], p<0,0001 par rapport à la valeur initiale), - de la démonstration dun bénéfice biologique en termes de taux de chlorure sudoral (critère de jugement secondaire hiérarchisé), avec une quantité d'effet supplémentaire démontrée par rapport aux comparateurs cliniquement pertinents qui avaient eux-mêmes apporté un progrès thérapeutique notable dans la prise en charge de la mucoviscidose, - du profil de tolérance de la trithérapie qui apparait favorable, - du besoin médical partiellement couvert dans lindication évaluée, Ce malgré : - labsence de démonstration robuste dun impact de |
|
| Avis du 13/10/2021 | Réévaluation suite à résultats étude post-inscript | La Commission estime que les données de cette étude ne sont pas de nature à modifier lappréciation de lamélioration du service médical rendu formulée dans les avis précédents du 7/11/2012, 5/11/2014, 2/03/2016, 10/7/2019, 3/06/2020, 30/06/2021. | |
| Avis du 07/07/2021 | Extension d'indication | Compte tenu : - de la démonstration dune efficacité modérée en termes de variation absolue de lindice de clairance pulmonaire ICP2,5 moyenne (critère de jugement principal) jusquà 8 semaines de traitement avec une différence de -0,51 points (IC95% [-0,74 . -0,29] . p<0,0001) en faveur de SYMKEVI (tezacaftor/ivacaftor) en association à KALYDECO (ivacaftor) par rapport au placebo dans une étude de phase III ayant inclus une majorité de patients (77,6%) homozygotes pour la mutation F508del du gène CFTR et une minorité (22,4%) de patients hétérozygotes pour la mutation F508del du gène CFTR, - du profil de tolérance qui apparait acceptable chez lenfant âgé de 6 ans à 11 ans, - du besoin médical identifié dans cette maladie rare, relayé par lassociation de patients, Et malgré : - les résultats exploratoires sur les paramètres biologiques, de croissance staturopondérale, symptomatiques et sur la qualité de vie de SYMKEVI (tezacaftor/ivacaftor) en association à KALYDECO (ivacaftor), - labsence |
|
| Avis du 07/07/2021 | Extension d'indication | Compte tenu : - de la démonstration dune efficacité modérée en termes de variation absolue de lindice de clairance pulmonaire ICP2,5 moyenne (critère de jugement principal) jusquà 8 semaines de traitement avec une différence de -0,51 points (IC95% [-0,74 . -0,29] . p<0,0001) en faveur de SYMKEVI (tezacaftor/ivacaftor) en association à KALYDECO (ivacaftor) par rapport au placebo dans une étude de phase III ayant inclus une majorité de patients (77,6%) homozygotes pour la mutation F508del du gène CFTR et une minorité (22,4%) de patients hétérozygotes pour la mutation F508del du gène CFTR, - du profil de tolérance qui apparait acceptable chez lenfant âgé de 6 ans à 11 ans, - du besoin médical important car non couvert en labsence dalternative disponible pour ces patients hétérozygotes pour la mutation F508del, relayé par lassociation de patients, Et malgré : - les résultats exploratoires sur les paramètres biologiques, de croissance staturo-pondérale, symptomatiques et sur la qualité de vie |
|
| Avis du 05/11/2014 | Extension d'indication | KALYDECO apporte une amélioration du service médical rendu importante (ASMR II) dans la prise en charge thérapeutique de la mucoviscidose chez les patients âgés de 6 ans et plus et porteurs de lune des mutation de défaut de régulation (classe III) du gène CFTR suivantes : G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N ou S549R. | |
| V (Inexistant) | Avis du 05/11/2014 | Inscription (CT) | KALYDECO 150 mg, comprimé pelliculé, plaquette thermoformée est un complément de gamme qui napporte pas damélioration du service médical rendu (ASMR V, inexistante) par rapport aux autres présentations déjà inscrites. |
| Avis du 07/11/2012 | Inscription (CT) | KALYDECO apporte une amélioration du service médical rendu importante (ASMR II) dans la prise en charge thérapeutique de la mucoviscidose chez les patients âgés de 6 ans et plus et porteurs de la mutation CFTR-G551D. |