Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Ce médicament n'appartient à aucun groupe générique
 Solution (Composition pour Un flacon)
Solution (Composition pour Un flacon)
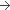 300 mg
300 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 30/05/2018 | Inscription (CT) | Le service médical rendu par OCREVUS est important dans « le traitement des patients adultes atteints de formes actives de sclérose en plaques récurrente (SEP-R) définies par des paramètres cliniques ou dimagerie (voir rubrique 5.1) |
| Modéré | Avis du 11/07/2018 | Inscription (CT) | le service médical rendu par OCREVUS est modéré dans « le traitement des patients adultes atteints de sclérose en plaques primaire progressive (SEP-PP) à un stade précoce en termes de durée de la maladie et de niveau du handicap, associé à des données dimagerie caractéristiques dune activité inflammatoire ». |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 30/05/2018 | Inscription (CT) | Prenant en compte : - la démonstration de supériorité de locrelizumab versus interféron ß-1a dans deux études de phase III sur le taux annualisée de poussée et sur le niveau de handicap . - avec un gain modeste et cliniquement pertinent sur ces critéres de jugement, sans amélioration de la qualité de vie de ces patients, - dans une population sélectionnée et majoritairement atteinte de SEP-RR à un stade précoce en termes de durée de la maladie et dactivité inflammatoire . - labsence de donnée comparative directe versus les traitements des formes très actives ou sévères de SEP-R . - labsence de données chez les patients atteints de SEP-SP active . - et les incertitudes majeures sur la tolérance au-delà de 2 ans dutilisation en particulier les conséquences au long terme dune lymphodéplétion par ocrelizumab dans cette maladie chronique évoluant sur de nombreuses années . La Commission considère quOCREVUS napporte pas damélioration du service médical rendu (ASMR V) dans la straté |
| Avis du 30/05/2018 | Inscription (CT) | Prenant en compte : - la démonstration de supériorité de locrelizumab versus interféron ß-1a dans deux études de phase III sur le taux annualisée de poussée et sur le niveau de handicap . - avec un gain modeste et cliniquement pertinent sur ces critéres de jugement, sans amélioration de la qualité de vie de ces patients, - dans une population sélectionnée et majoritairement atteinte de SEP-RR à un stade précoce en termes de durée de la maladie et dactivité inflammatoire . - labsence de donnée comparative directe versus les traitements des formes très actives ou sévères de SEP-R . - labsence de données chez les patients atteints de SEP-SP active . - et les incertitudes majeures sur la tolérance au-delà de 2 ans dutilisation en particulier les conséquences au long terme dune lymphodéplétion par ocrelizumab dans cette maladie chronique évoluant sur de nombreuses années . La Commission considère quOCREVUS apporte une amélioration de service médical rendu modérée (ASMR III) versus inter |
|
| V (Inexistant) | Avis du 11/07/2018 | Inscription (CT) | Prenante en compte : - la démonstration de la supériorité de locrelizumab versus placebo dans une seule étude de phase III, - le caractère sélectionné de la population de cette étude particulièrement en termes dâge (inférieur ou égal à 55 ans), - avec le gain en termes de délai dapparition dun handicap confirmé à 12 ou 24 semaines, modeste et dont la pertinence clinique nest pas assurée (gain absolu <4% après 120 semaines de traitement), - labsence damélioration de la qualité de vie de ces patients, - et les incertitudes majeures sur la tolérance à long terme dune lymphodéplétion par ocrelizumab dans cette maladie chronique évoluant sur de nombreuses années, la Commission considère quOCREVUS napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique de la sclérose en plaques primaire progressive. |