Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.

Ce médicament n'appartient à aucun groupe générique
 Solution (Composition pour 1 ml de solution)
Solution (Composition pour 1 ml de solution)
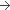 20 mg
20 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 07/12/2022 | Réévaluation ASMR | Le service médical rendu par DARZALEX (daratumumab) reste important dans lindication de lAMM faisant lobjet de la réévaluation « en association au lénalidomide et à la dexaméthasone, ou au bortézomib et à la dexaméthasone, pour le traitement des patients adultes atteints dun myélome multiple ayant reçu au moins un traitement antérieur. » |
| Important | Avis du 09/03/2022 | Réévaluation ASMR | Le service médical rendu par DARZALEX (daratumumab) reste important dans lindication : « en association avec le lénalidomide et la dexaméthasone pour le traitement des patients adultes atteints dun myélome multiple nouvellement diagnostiqué et non éligibles à une autogreffe de cellules souches ». |
| Important | Avis du 22/04/2020 | Extension d'indication | Le service médical rendu par DARZALEX (daratumumab) est important dans lindication « en association avec le bortézomib, le thalidomide et la dexaméthasone pour le traitement des patients adultes atteints dun myélome multiple nouvellement diagnostiqué et éligibles à une autogreffe de cellules souches ». |
| Important | Avis du 22/04/2020 | Réévaluation SMR et ASMR | Le service médical rendu par DARZALEX (daratumumab) reste important dans lindication « en association avec le bortézomib, le melphalan et la prednisone pour le traitement des patients adultes atteints dun myélome multiple nouvellement diagnostiqué et non éligibles à une autogreffe de cellules souches ». |
| Important | Avis du 22/04/2020 | Extension d'indication | Le service médical rendu par DARZALEX (daratumumab) est important dans lindication « en association avec le lénalidomide et la dexaméthasone pour le traitement des patients adultes atteints dun myélome multiple nouvellement diagnostiqué et non éligibles à une autogreffe de cellules souches ». |
| Important | Avis du 17/04/2019 | Extension d'indication | Le service médical rendu par DARZALEX est important dans lindication « en association avec le bortézomib, le melphalan et la prednisone pour le traitement des patients adultes atteints dun myélome multiple nouvellement diagnostiqué et non éligibles à une autogreffe de cellules souches ». |
| Important | Avis du 21/02/2018 | Extension d'indication | Le service médical rendu par DARZALEX est important dans lindication « en association au lénalidomide et à la dexaméthasone, ou au bortézomib et à la dexaméthasone, pour le traitement des patients adultes atteints dun myélome multiple ayant reçu au moins un traitement antérieur. » |
| Important | Avis du 22/11/2017 | Inscription (CT) | Le service médical rendu par DARZALEX est important en monothérapie, pour le traitement des patients adultes atteints dun myélome multiple en rechute et réfractaire, pour lesquels les traitements antérieurs incluaient un inhibiteur du protéasome et un agent immunomodulateur et dont la maladie a progressé lors du dernier traitement. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Avis du 07/12/2022 | Réévaluation ASMR | " Compte-tenu : ¿ de la supériorité de la trithérapie associant DARZALEX (daratumumab), au lénalidomide et à la dexaméthasone, ou au bortézomib et à la dexaméthasone, démontrée par rapport aux associations lénalidomide et dexaméthasone (Rd), ou bortézomib et dexaméthasone en termes de survie sans progression dans les études CASTOR et POLLUX, ¿ de la supériorité désormais montrée par rapport à lassociation lénalidomide et dexaméthasone ou bortézomib et dexaméthasone en termes de survie globale avec un gain absolu de 11,1 mois dans létude CASTOR et de 15,8 mois dans létude POLLUX, et malgré : ¿ le profil de tolérance à long terme confirmant la fréquence plus élevée dévénements indésirables de grades 3-4, dans les groupes avec ajout du daratumumab, et marqué par des EI de type hématologique et infectieux, ¿ labsence de données robustes sur la qualité de vie, la Commission de la Transparence considère que DARZALEX (daratumumab) en association au lénalidomide et à la dexaméthasone, ou au |
|
| Avis du 09/03/2022 | Réévaluation ASMR | DARZALEX (daratumumab) en association au lénalidomide et à la dexaméthasone (protocole Rd), apporte une amélioration du service médical rendu modérée (ASMR III) par rapport au protocole Rd dans le traitement des patients adultes atteints dun myélome multiple nouvellement diagnostiqué et non éligibles à une autogreffe de cellules souches. | |
| Avis du 22/04/2020 | Extension d'indication | " Compte tenu : - de la démonstration de la supériorité de lajout de DARZALEX (daratumumab) au bortézomib, au thalidomide et à la dexaméthasone (protocole D-VTd) par rapport au protocole VTd administré seul, à lissue de 4 cycles dinduction suivis de 2 cycles de consolidation, en termes de survie sans progression (HR=0,47, IC95% [0,33 0,67], gain médian non quantifiable à ce jour), - des résultats obtenus sur la maladie résiduelle minimale indétectable, (critère de jugement secondaire hiérarchisé) avec D-VTd par rapport à VTd (64 % versus 44 %) même sil nest pas démontré à ce jour que la MRD est un critère de substitution de la survie globale, mais au regard : - de labsence de gain démontré en survie globale à la date de lanalyse, - de labsence dimpact démontré sur la qualité de vie, - et de la fréquence plus élevée dévènements indésirables de grades 3-4 dans le groupe traité par le protocole D-VTd, notamment les neutropénies sévères (28 % versus 15 %), lymphopénies sévères |
|
| Avis du 22/04/2020 | Réévaluation SMR et ASMR | " Compte tenu : - de la démonstration de la supériorité de lajout de DARZALEX (daratumumab) au bortézomib, au melphalan et à la prednisone (protocole D-VMP) par rapport au protocole VMP, en termes de survie globale (réduction du risque de décès de 40 %, HR = 0,60 [IC95% : 0,46 0,80]) après un suivi médian de 40 mois, - et de la confirmation dun gain en survie sans progression (gain médian de 17 mois), et malgré : - labsence dimpact démontré sur la qualité de vie, - et la fréquence plus élevée dévénements indésirables graves avec le protocole D-VMP par rapport au protocole VMP (48 % versus 33 %), notamment davantage de pneumonies graves (12 % versus 3 %), la Commission considère que DARZALEX (daratumumab) en association au bortézomib, au melphalan et à la prednisone (protocole VMP), apporte une amélioration du service médical rendu modérée (ASMR III) par rapport au protocole VMP dans le traitement des patients adultes atteints dun myélome multiple nouvellement diagnostiqué et non éli |
|
| Avis du 22/04/2020 | Extension d'indication | " Compte tenu : - de la démonstration de la supériorité de lajout de DARZALEX (daratumumab) au lénalidomide et à la dexaméthasone (protocole D-Rd) par rapport au protocole Rd, administrés jusquà progression, après un suivi médian de 28 mois, en termes de survie sans progression (HR = 0,56 [IC95% : 0,43 0,73], gain médian non quantifiable à ce jour), - des résultats obtenus sur la maladie résiduelle minimale indétectable (critère de jugement secondaire hiérarchisé) avec D-Rd par rapport à Rd (24 % versus 7 %) même sil nest pas démontré que la MRD est un critère de substitution de la survie globale à ce jour, mais au regard : - de labsence de gain démontré en survie globale à la date de lanalyse, - de labsence dimpact démontré sur la qualité de vie, - et de la fréquence plus élevée dévènements indésirables de grades 3-4 avec le protocole D-Rd par rapport au protocole Rd (90 % versus 83 %) ayant concerné principalement les neutropénies (50 % versus 35 %) et les pneumonies (14 % ve |
|
| Avis du 17/04/2019 | Extension d'indication | " Compte tenu: - de la démonstration de la supériorité de lajout de DARZALEX (daratumumab) au protocole MPV (comportant le bortezomib, le melphalan et la prednisone) par rapport au protocole MPV administré seul en termes de survie sans progression, sans toutefois de gain démontré en survie globale et en qualité de vie à la date de lanalyse, - de la fréquence plus élevée dévénements indésirables graves avec lassociation D-MPV (41,6 % versus 32,5%), avec notamment davantage de pneumonies graves (10,1% versus 3,1%), la Commission considère que, dans lattente des résultats sur la survie globale, DARZALEX en association au bortézomib, au melphalan et à la prednisone (protocole MPV), apporte une amélioration du service médical rendu mineure (ASMR IV) par rapport au protocole MPV administré seul dans le traitement des patients adultes atteints dun myélome multiple nouvellement diagnostiqué et non éligibles à une autogreffe de cellules souches. " |
|
| Avis du 21/02/2018 | Extension d'indication | " Compte tenu : - des résultats defficacité fondés principalement sur la survie sans progression et le taux de réponse, - sans toutefois de gain démontré en survie globale et en qualité de vie, la Commission considère que dans lattente des résultats sur la survie globale, DARZALEX, en association à une bithérapie par lénalidomide/dexaméthasone, ou par bortézomib/dexaméthasone apporte une amélioration du service médical rendu mineure (ASMR IV) par rapport à chacune de ces bithérapies utilisées seules dans le traitement du myélome multiple après au moins un traitement antérieur. " |
|
| V (Inexistant) | Avis du 22/11/2017 | Inscription (CT) | " Compte tenu : - des données defficacité issues de sous-groupes de deux études de phase II, - de labsence de données comparatives notamment versus le pomalidomide en troisième ligne, la Commission considère que DARZALEX en monothérapie napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique. " |