Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.

Ce médicament n'appartient à aucun groupe générique
 Comprimé (Composition pour Un comprimé)
Comprimé (Composition pour Un comprimé)
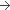 5 mg
5 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Faible | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Dans la spondylarthrite ankylosante, le service médical rendu par XELJANZ (tofacitinib) est faible uniquement chez les patients ayant une intolérance ou une réponse inadéquate à au moins un anti-TNF. |
| Important | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Dans larthrite juvénile idiopathique, le service médical rendu par XELJANZ (tofacitinib), est important uniquement chez les patients ayant une intolérance ou une réponse inadéquate à un DMARD antérieur dont au moins un anti-TNF lorsque cela est possible. Dans la polyarthrite rhumatoïde, le service médical rendu par XELJANZ (tofacitinib) est important uniquement chez les patients ayant une intolérance ou une réponse inadéquate à un ou plusieurs DMARD dont au moins un anti-TNF. |
| Insuffisant | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Dans larthrite juvénile idiopathique, le service médical rendu par XELJANZ (tofacitinib) est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. Dans la polyarthrite rhumatoïde, le service médical rendu par XELJANZ (tofacitinib) est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. Dans le rhumatisme psoriasique, le service médical rendu par XELJANZ (tofacitinib) est insuffisant pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. Dans la spondylarthrite ankylosante, le service médical rendu par XELJANZ (tofacitinib) est insuffisant pour justifier dune prise en charge par la solidarité nationale dans les autres situations de lAMM. |
| Modéré | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Dans le rhumatisme psoriasique, le service médical rendu par XELJANZ (tofacitinib) est modéré, en association au MTX, uniquement chez les patients ayant une intolérance ou une réponse inadéquate à un ou plusieurs DMARD dont au moins un anti-TNF. |
| Important | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Le service médical rendu est important pour XELJANZ (tofacitinib) dans le traitement de la rectocolite hémorragique active modérée à sévère chez les patients adultes qui ont eu une réponse inadéquate, une perte de réponse ou une intolérance aux traitements conventionnels, à au moins un anti-TNFa et au védolizumab, et lorsque les alternatives sont moins appropriées. |
| Insuffisant | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Le service médical rendu est insuffisant pour XELJANZ (tofacitinib) pour justifier dune prise en charge par la solidarité nationale au regard des alternatives disponibles dans les autres situations de lAMM. |
| Faible | Avis du 14/12/2022 | Extension d'indication | Le service médical rendu par XELJANZ (tofacitinib) est faible dans lextension dindication de lAMM. |
| Important | Avis du 20/04/2022 | Extension d'indication | Le service médical rendu par XELJANZ (tofacitinib) est important dans la nouvelle indication de lAMM. |
| Important | Avis du 20/03/2019 | Extension d'indication | Le service médical rendu par XELJANZ dans le traitement de la RCH active modérée à sévère est important chez les patients en échec (réponse insuffisante, perte de réponse ou intolérance) au traitement conventionnel (amino-5 salicylés, corticoïdes et immunosuppresseurs) et au traitement par anti-TNF. |
| Insuffisant | Avis du 20/03/2019 | Extension d'indication | Le service médical rendu par XELJANZ dans le traitement de la RCH active modérée à sévère est insuffisant pour justifier dune prise en charge par la solidarité nationale chez les patients ayant une réponse inadéquate, une perte de réponse ou une intolérance au traitement conventionnel (cest à dire les patients naïfs danti-TNF), au regard des alternatives existantes. |
| Modéré | Avis du 05/12/2018 | Extension d'indication | Le service médical rendu par XELJANZ est modéré dans lindication de lAMM. |
| Important | Avis du 27/09/2017 | Inscription (CT) | Le service médical rendu par XELJANZ est important dans l'indication de l'AMM. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS . Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 29/11/2023 | Réévaluation SMR et ASMR | Dans larthrite juvénile idiopathique : ASMR V Dans la polyarthrite rhumatoïde : ASMR V Dans le rhumatisme psoriasique : ASMR V Dans la spondylarthrite ankylosante : ASMR V |
| V (Inexistant) | Avis du 29/11/2023 | Réévaluation SMR et ASMR | " Compte tenu : ¿ des nouvelles données cliniques defficacité ne modifiant pas lappréciation de lefficacité en comparaison au placebo . ¿ de labsence de données defficacité solides comparant les anti-JAK entre eux ou avec les alternatives médicamenteuses (anti-TNF et védolizumab de 2ème ligne et ustékinumab en 3ème ligne) . ¿ de labsence deffets établis sur la qualité de vie au long cours (en dehors de lupadacitinib jusquà 52 semaines versus placebo), sur les complications et le recours à la colectomie . ¿ et du profil de tolérance actualisé de la classe des anti-JAK, avec notamment un risque accru de tumeurs, dévénements thromboemboliques veineux ou artériels et dinfections graves, voire de décès, en comparaison aux anti-TNF, et de labsence de données cliniques permettant décarter ces risques en comparaison aux alternatives médicamenteuses . la Commission considère que XELJANZ (tofacitinib) napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie théra |
| V (Inexistant) | Avis du 14/12/2022 | Extension d'indication | " Compte tenu : ? du bénéfice clinique démontré versus placebo en termes de pourcentage de répondeurs ASAS 20 et 40, dactivité de la maladie, de capacités fonctionnelles et de qualité de vie sur 270 patients à la semaine 16 et du maintien de leffet suggéré à la semaine 48 sur le critère ASAS 20 . ? de labsence de démonstration de sa supériorité par rapport au placebo en termes defficacité structurale, ? de labsence de donnée comparative versus les anti-TNF ou anti-IL17 alors que la comparaison était réalisable, ? de labsence de donnée robuste chez les patients en échec dun traitement biologique (soit en 3ème ligne et plus), ? et des inquiétudes en termes de tolérance à long terme, portant en particulier sur les risques infectieux et les risques potentiels cardiovasculaires et carcinogènes, la Commission considère que XELJANZ (tofacitinib) napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique actuelle. " |
| V (Inexistant) | Avis du 20/04/2022 | Extension d'indication | XELJANZ (tofacitinib) napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie de prise en charge des arthrites juvéniles idiopathiques polyarticulaires (polyarthrite à facteur rhumatoïde positif [RF+] ou négatif [RF-] et oligoarthrite étendue) et du rhumatisme psoriasique (RP) juvénile chez les patients âgés de 2 ans et plus, ayant présenté une réponse inadéquate à un traitement par DMARD antérieur. |
| Avis du 20/03/2019 | Extension d'indication | " Compte tenu : - des résultats des études OCTAVE 1, 2 et OCTAVE Sustain démontrant un bénéfice clinique en comparaison au placebo en termes dinduction de la rémission clinique à 8 semaines et de maintien de cette rémission jusquà 52 semaines chez des patients en échec du traitement conventionnel ou par anti-TNF, avec une quantité deffet modérée et du profil de tolérance connu du tofacitinib . - de labsence de donnée clinique en 2ème ligne de traitement ayant comparé XELJANZ à un anti-TNF . - du fait que XELJANZ représente une nouvelle alternative (par voie orale) en 3ème ligne de traitement, chez les patients en échec au traitement conventionnel et à un traitement par anti-TNF . la Commission de la transparence considère que la XELJANZ (tofacitinib) apporte une amélioration du service médical rendu mineure (ASMR IV) chez les patients atteints de rectocolite hémorragique active modérée à sévère en échec (réponse insuffisante, perte de réponse ou intolérance) du traitement conventionnel et des |
|
| V (Inexistant) | Avis du 05/12/2018 | Extension d'indication | " Compte tenu : - de la démonstration de la supériorité du tofacitinib 5 mg par rapport au placebo chez des patients ayant eu une réponse inadéquate à un traitement de fond conventionnel et naïfs danti-TNF ainsi que chez des patients en échec dau moins un anti-TNF, en termes de taux de réponse ACR20 et de variation du score dincapacité fonctionnelle HAQ-DI, - de la faible pertinence clinique du co-critère de jugement principal ACR20, - de labsence de démonstration dune efficacité sur la destruction articulaire, critère de jugement pertinent dans cette maladie, - de labsence de donnée comparative versus les anti-TNF alors que cette comparaison était possible, - du besoin médical partiellement couvert notamment par les anti-TNF qui ont démontré leur efficacité sur la destruction articulaire, la Commission de la transparence considère que XELJANZ napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie de prise en charge du rhumatisme psoriasique actif chez les pa |
| V (Inexistant) | Avis du 27/09/2017 | Inscription (CT) | Prenant en compte : - la non-infériorité de XELJANZ (tofacitinib) en association au méthotrexate (MTX) par rapport à ladalimumab (HUMIRA) en association au MTX en 2ème intention cest-à-dire après échec du MTX, - labsence de comparaison aux alternatives disponibles en 3ème intention (notamment tocilizumab, abatacept, rituximab) alors quelle était faisable, - et les inquiétudes en termes de tolérance à long terme, portant en particulier sur les risques infectieux et les risques potentiels cardiovasculaires et carcinogènes, la Commission de la transparence considère que XELJANZ napporte pas damélioration du service médical rendu (ASMR V) dans la stratégie de prise en charge de la polyarthrite rhumatoïde active modérée à sévère chez les patients adultes qui ont eu une réponse inadéquate, ou une intolérance, à un ou plusieurs traitements de fond. La stratégie thérapeutique de prise en charge la polyarthrite rhumatoïde active modérée à sévère, en 2eme ligne et plus, chez les patients adult |